Il gruppo è coordinato dal Prof. Giuseppe Orsomando e le principali attività del laboratorio sono relative a:
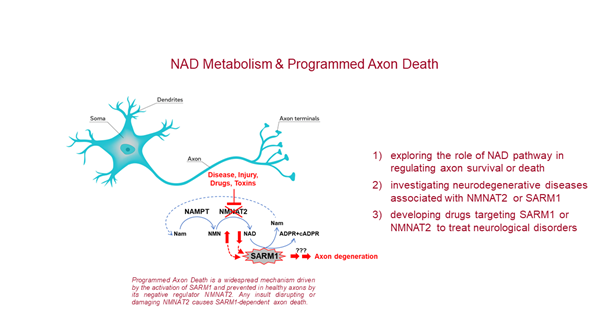
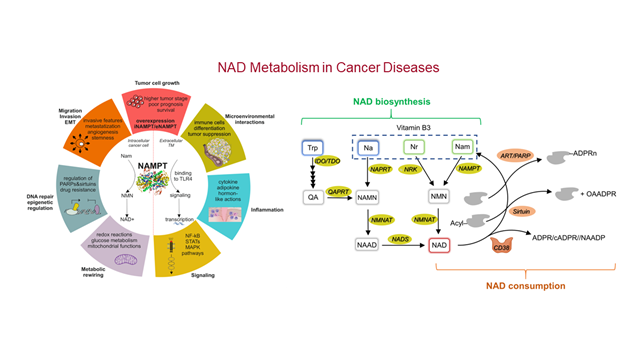
Il gruppo ha a disposizione un laboratorio pienamente equipaggiato e attrezzato con strumenti e materiali per:
Prof. Michael P. Coleman
University of Cambridge, UK.
Dott.ssa Valentina Audrito
Università del Piemonte Orientale, Italia.
